Hidrólisis enzimática
Se entiende por hidrólisis enzimática la hidrólisis que se produce mediante un grupo de enzimas llamadas hidrolasas.
Estas enzimas ejercen un efecto catalítico hidrolizante, es decir,
producen la ruptura de enlaces por agua según: H-OH + R-R’ → R-H +
R’-OH.
Se nombran mediante el nombre del sustrato
seguido de la palabra hidrolasa, y cuando la enzima es específica para
separar un grupo en particular, éste puede utilizarse como prefijo. En
algunos casos este grupo puede ser transferido por la enzima a otras moléculas y se considera la hidrólisis misma como una transferencia del grupo al agua.
A veces suele utilizarse el nombre común de la enzima, por lo que
muchas veces el sufijo –asa, nos indicará generalmente que se trata de
una hidrolasa. Por ahora no ha sido posible encontrar una nomenclatura
sistemática para todas las péptido-hidrolasas, por lo que hoy en día,
para las nuevas enzimas, su nombre se forma según: fuente de péptido
hidrolasa seguido, si es necesario, de una letra para distinguirla de
otra enzima.1
A continuación se explican todos los grupos de enzimas hidrolasas, citando como ejemplos las más importantes en humanos.
Estas enzimas ejercen un efecto catalítico hidrolizante, es decir,
producen la ruptura de enlaces por agua según: H-OH + R-R’ → R-H +
R’-OH.
Se nombran mediante el nombre del sustrato
seguido de la palabra hidrolasa, y cuando la enzima es específica para
separar un grupo en particular, éste puede utilizarse como prefijo. En
algunos casos este grupo puede ser transferido por la enzima a otras moléculas y se considera la hidrólisis misma como una transferencia del grupo al agua.
A veces suele utilizarse el nombre común de la enzima, por lo que
muchas veces el sufijo –asa, nos indicará generalmente que se trata de
una hidrolasa. Por ahora no ha sido posible encontrar una nomenclatura
sistemática para todas las péptido-hidrolasas, por lo que hoy en día,
para las nuevas enzimas, su nombre se forma según: fuente de péptido
hidrolasa seguido, si es necesario, de una letra para distinguirla de
otra enzima.1
A continuación se explican todos los grupos de enzimas hidrolasas, citando como ejemplos las más importantes en humanos.
Índice
- 1 Actuando sobre enlaces éster
- 2 Actuando sobre compuestos glicosílicos
- 3 Actuando sobre enlaces éter
- 4 Actuando sobre enlaces péptido
- 5 Actuando sobre enlace C-N diferente al péptido
- 6 Actuación sobre enlaces de ácido–anhídrido
- 7 Actuando sobre enlaces C-C
- 8 Actuando sobre enlaces haluro
- 9 Actuando sobre enlaces P-N
- 10 Obtención de Esterasas
- 11 Hidrólisis catalizada por metaloenzimas
- 12 Véase también
- 13 Referencias
Actuando sobre enlaces éster
Bajo el nombre de esterasas se comprenden una amplia cantidad deimportantes enzimas que producen la ruptura del enlace éster formado por
los ácidos inorgánicos (fosfórico, sulfúrico) u orgánicos diversos con
diferentes alcoholes o tioles.
Pese a las numerosas investigaciones existe todavía cierta
incoherencia, dada la escasa especificidad de acción para muchas
esterasas.2 Se han formado seis subgrupos, de acuerdo con la reacción típica:
Ésteres de ácidos orgánicos
- Con alcoholes RCOOR’ + H2O → RCOOH + R’OH
- Con tioles RCOSR’ + H2O → RCOOH + R’SH
- Con ácido fosfórico:
-
-
-
- - Monoéster fosfórico
- - Diéster fosfórico
- - Monoéster trifosfórico
-
-
- Con ácido sulfúrico: RO-SO3H + H2O → ROH + SO4H2
Carboxílico éster hidrolasas
En este primer subgrupo se encuentran las enzimas características dela hidrólisis de los lípidos. Las esterasas se presentan tanto en reino
animal como en el vegetal. Algunas reacciones son reversibles, es decir,
que son capaces de producir hidrólisis y síntesis. Las enzimas más importantes son:
- - Glicerol-éster hidrolasa.
Cataliza la reacción: Triglicérido + H2O → Diglicérido + un ion de
ácido graso. Es menos activa para los diglicéridos e inactiva con
monoglicéridos. Proviene del páncreas y se halla también en el plasma sanguíneo, eritrocitos
y leucocitos. También se admite una cierta capacidad por parte de la
mucosa gástrica y del intestino delgado para la síntesis de la lipasa en
vista de que, con la pancreotomía se produce un fuerte descenso del
nivel sanguíneo, pero que vuelve al normal al cabo de algunas semanas.
Tiene cierto valor diagnóstico que los valores en orina que se ven
aumentados en los casos de carcinoma pancreático. Clínicamente se estima
que, en parte, interviene una escasa formación o una normal inhibición
de la lipoproteidolipasa en la hipercolesterolemia, especialmente en conexión con hiperlipemia y quizás otros trastornos del metabolismo de la colesterina.
- - Lisolecitina acil hidrolasa o fosfolipasa B
quedando como producto final el éster glicerol fosfórico de la colina,
con lo que conseguimos desintoxicar a la lisolecitina que es hemolítica.
- - Acetilcolinesterasa o acetilcolina hidrolasa
también actúa sobre otros ésteres acéticos y cataliza
transacetilaciones. Se localiza en el sistema nervioso central, en las
placas terminales motóricas del músculo estriado, en la placenta y superficie de eritrocitos, así como en los trombocitos.
- - Acilcolina acilhidrolasa o colinesterasa
de colina, es poco específica. Se encuentra en casi todos los tejidos,
principalmente suero sanguíneo y glándulas como testículos,
páncreas e hígado donde con gran probabilidad se forma y localiza en
los microsomas. Los valores de esta enzima se ven alterados en
patologías muy diversas, como afecciones parenquimatosas hepáticas,
hepatitis aguda, colangitis, lesión alcohólica hepática, cardiopatías descompensadas, malignoma hepático, infarto de miocardio, síndrome nefrótico, etc.
- - Colesterol esterasa
encuentra en el páncreas, hígado, suero, etc. Su determinación en el
suero sanguíneo se utiliza para el diagnóstico (junto con otras pruebas)
y pronóstico de la hepatitis vírica.En general la disminución de la
enzima cursa paralela a la gravedad de la lesión hepática, pero no tiene
valor decisivo para un diagnóstico diferencial ya que en la mayoría de
colecistitis, colangitis, etc., presentan valores normales.
- - Vitamina-A-acetato hidrolasa
- - Carboxílico-éster hidrolasa.
Tioléster hidrolasas
- - Cinco enzimas activas sobre acil derivados de la coenzima A, separándola: Acetil CoA, Palmitoil-CoA, succinil-CoA, 3-hidroxi-isobutiril y 3-hidroxi-3uuu-metilglutaril-CoA hidrolasa. Están presentes en el hígado, corazón, cerebro y riñón de cerdo. La cuarta también hidroliza la 3-hidroxipropionil-CoA.
- - Tres enzimas actúan sobre acil derivados del glutatión separándolo: S-2-hidroxiacilglutatión, S-acilglutatión, S-acetoacetilglutatión hidrolasa.
Fosfórico monoéster hidrolasas
Abundan en animales, plantas, bacterias, hongos y levadura. Las dosprimeras enzimas son las más importantes y poseen el mismo nombre
sistemático de:
- - Ortofosfórico monoéster fosfohidrolasa o fosfatasas ácida y alcalina.
Poseen una amplia especificidad, catalizando también
transfosforilaciones. Se ha observado una variación en sangre en
afecciones hepatobiliares y procesos óseos. La determinación de la
enzima leucocitaria se usa para la diferenciación de tipos de trastornos
mieloproliferativos, policitemia
y es de algún valor en el diagnóstico precoz del embarazo. La fosfatasa
ácida está muy difundida por los tejidos humanos, pero con mayor
actividad que la alcalina y casi ausente en huesos y mucosa intestinal.
Abunda en los vegetales, levadura e hidroliza difícilmente los ésteres
fosfóricos de amino-alcoholes, mientras que la de la próstata humana lo hace más rápidamente. La fracción eritrocítica es de gran interés en pruebas de paternidad.
- - Fosfoserina fosfohidrolasa
- - 5’-ribonucleótido fosfohidrolasa y 3’-ribonucleótido fosfohidrolasa
correspondiente. Se encuentra ampliamente distribuida en el cuerpo,
siendo los órganos más ricos la próstata, lóbulo posterior de la hipófisis, hígado, viniendo luego cerebro, riñón,
testículos, etc. La determinación de su actividad sérica se aplica en
clínica paralelamente a la determinación de la fosfatasa alcalina. Se
han encontrado valores superiores al normal en pacientes con tuberculosis, amiloidosis, pacientes con oclusiones de vías biliares, etc.
- - Adenosina-3’-5’-difosfato 3’-fosfohidrolasa
- - Meso-inositol hexafosfato fosfohidrolasa
malta de cebada y alfalfa. Cataliza la reacción: Meso-inositol
hexafosfato + 6 H2O → meso-inositol + 6 ortofosfato. En particular las
de la flora intestinal bacteriana son de importancia pues intervienen así en la asimilación del calcio.
- - D-glucosa-6-fosfato fosfohidrolasa
últimas etapas de la glicogenólisis catalizando la importante reacción,
muy específica: D-glucosa-6-fosfato + H2O → D-glucosa + ortofosfato Su
déficit es considerado como la causa originaria de la enzimopatía
recesiva autosómica denominada tesaurosis de glucógeno tipo 1
hepatorrenal o enfermedad de von Gierke-Cori, donde sólo se encuentra el
1-10% de la cantidad normal de la enzima en el hígado. También actúa
sobre la D-glucosamina-6-fosfato y lentamente sobre la
fructosa-6-fosfato.
- - D-glucosa-1-fosfato fosfohidrolasa
ortofosfato. También actúa, más lentamente, sobre la D-galactosa
1-fosfato.
- - D-fructosa-1,6-difosfato 1-fosfohidrolasa
ausente en intestino. Es activada por el ion magnesio. Cataliza la
reacción: D-fructosa 1,6-fosfato + H2O → D-fructosa-6-fosfato +
ortofosfato.
- - Fosfoproteína fosfohidrolasa
ortofosfato. Actúa sobre la caseína y otras fosfoproteínas. La enzima
del bazo también actúa sobre fosfatos fenólicos y fosfoamidas.
Fosfórico diéster hidrolasas
Son las fosfodiesterasas, por escindir tan sólo uno de los enlaces deun diéster-ortofosfórico, siendo necesaria luego la acción de una
monofosfoesterasa para la completa hidrólisis del diéster. Abundan en la
cáscara de arroz y el veneno de las serpientes.
- - Ortofosfórico diéster fosfohidrolasa
- - L-3-glicerofosforilcolina glicerofosfohidrolasa
- - Desoxirribonucleato oligonucleotidohidrolasa y desoxirribonucleato 3’-nucleotidohidrolasa
desoxirribonucleicos de elevado peso molecular a mononucleótidos y
mononucleótidos, según: DRNA + (n-1) H2O → n
oligo-desoxirribonucleótidos Otras nucleasas de la mucosa intestinal y
la fosfodiesterasa completan la hidrólisis. Ambas enzimas se encuentran
en las células de diversos órganos, con mayor cantidad en los tejidos de
gran actividad mitósica, pero mientras que la primera localizada en el
núcleo celular es prácticamente inactiva y sólo se activa al agregar
iones magnesio, la segunda es inactivada por estos iones. Ambas se
hallan en el plasma sanguíneo humano. Se han podido comprobar también en
el líquido cefalorraquídeo y se excretan por la orina. Algunas
patologías en las que se ha observado una variación de esta enzima son
afecciones pancreáticas, hepatitis, leucemia, lupus eritematoso, etc.
Trifosfórico monoéster hidrolasas
- - La desGTP trifoshidrolasa
Sulfúrico éster hidrolasas o sulfatasas
Hidrolizan los sulfatos de ésteres según: R-O-SO3H + H2O = ROH + SO4H2- - Arisulfato sulfohidrolasa
Actuando sobre compuestos glicosílicos
Glicósido hidrolasas
Amilasa de la saliva humana.
- - α-amilasa o α-1,4-glucán 4-glucanohidrolasa
más unidades D-glucosa enlazadas α-1,4 y actuando al azar, sobre
almidón, glucógeno, polisacáridos relacionados y oligosacáridos.
- - β-amilasa o α-1,4-glucán maltohidrolasa
separa sucesivas unidades maltosa de los finales no reductores de las
cadenas. Actúa sobre almidón, glucógeno, polisacáridos relacionados y
oligosacáridos produciendo beta maltosa por una inversión.
- - α-1,4-glucán glucohidrolasa
- α-amilasa.
-
- Amilasa animal salivar y pancreática. Se consideran isoenzimas. De
la pancreática, se originan principalmente la amilasa sanguínea y
urinaria. Es dudosa la presencia en hígado, riñones y líquido
cefalorraquídeo. Se encuentra también en el músculo, esperma y las heces
así como en la leche de la mujer lactante. - Amilasa vegetal. Presente en avena, maíz, cebada, etc.
- Amilasa de mohos. Enzima muy utilizada en industria.
- Amilasas bacterianas. De utilidad industrial.
- Amilasa animal salivar y pancreática. Se consideran isoenzimas. De
- β-amilasa
- Glucoamilasa
y a la albúmina. La determinación de la amilasa en la sangre es
importante en clínica para el diagnóstico (precoz o de confirmación)
diferencial de la pancreatitis aguda, pero su negatividad no asegura la
ausencia de la patología. Su valor se ve alterado en otras muchas
patologías como perforaciones de úlcera gástrica, pancreatitis crónica,
parotiditis, oclusión litiásica, etc.
- - N-acetilmuramilhidrolasa o mucopéptido glucohidrolasa
entre el ácido N-acetilmuramínico y los radicales de
2-acetilamino-2-desoxi-D-glucosa, en un mucopolisacárido o mucopéptido.
Posee propiedad bacteriolítica por hidrolizar el enlace azúcar de los
acetilaminopolisacáridos, que son parte esencial de la pared celular de
muchas bacterias.
Su papel en procesos vitales del organismo no está muy clara, pero se
dice que su función principal es la intervenir en el metabolismo.Se ha
intuido una relación entre ulceración y anormal cantidad de lisozima ya
que, por ejemplo, en la fase aguda de la colitis ulcerosa se encuentran
grandes cantidades de lisozima en las heces.
- - β-D-galactósido galactohidrolasa
en o-nitrofenilgalactopiranósido. Se encuentra en el intestino fetal,
en Heliz pomatia, B.coli, Delbrucki y en las almendras. Interviene en el
síndrome diarreico por leche y en la colitis. También cataliza
reacciones de galactotranferasa.
- - β-D-fructofuranósido fructohidrolasa
D-fructosa. Entre los sustratos se incluye la sacarosa, que se desdoble
en fructosa y glucosa. También cataliza reacciones de fructotransferasa.
Se encuentra en el intestino, hongos, plantas y cultivos de suelos
fangosos.
- - β-D-glucurónido glucuronohidrolasa
aromáticos, hidroliza algunos productos de excresión hormonal y también
transfiere radicales glucuronil sobre alcohol aceptor. Se encuentra en
numerosas barterias, plantas, E.coli, caracoles, moluscos, pájaros y
peces. También se encuentra en casi todos los tejidos animales y en el
humano se han señalado el hígado, bazo, glándulas suprarrenales,
placenta, próstata, riñón, intestinos, parótidas y sobre todo, en el
endometrio. En la célula se encuentra localizada en las lisosomas y
microsomas. En el suero sanguíneo del hombre hay menor cantidad que en
la mujer, para la que aumenta con la menopausia.
Debido a sus propiedades catalíticas juega un papel importante en el
mecanismo de desintoxificación de sustancias extrañas al cuerpo.
En clínica es importante su determinación de actividad sérica para el diagnóstico precoz de la preeclampsia,
pues aumenta más o menos intensamente ya antes de aparecerlos síntomas.
También es de interés para el diagnóstico de carcinoma de útero,
glioblastoma multiforme, tumores de vejiga, etc.
- - Dextrina 6-glucanohidrolasa
laterales cortas enlazadas. El déficit de esta enzima se atribuye a
patologías como la enfermedad de Cori, tesaurismo de glucógeno hepático y
muscular de carácter hereditario.
Actuando sobre enlaces éter
Tioéter hidrolasa
Comprende sólo una enzima, la S-adenosil-L-homocisteína. Intervieneen el metabolismo de los aminoácidos sulfurados y da lugar a la
adenosina y L-homocisteína.
Actuando sobre enlaces péptido
Alfa amino acil péptido hidrolasas
Su característica es separar por hidrólisis el aminoácido situado enel extremo N-terminal (con grupo amino libre). También catalizan con
facilidad reacciones transpeptidación por intercambio de aminoácido.
Probablemente hay un gran número de peptidasas de esta especificidad. Se
han estudiado cuatro principales, siendo la más importante:
- - L-leucil-peptidohidrolasa o leucina aminopeptidasa (LAP)
Se ha encontrado en plantas, bacterias y tejidos animales,
particularmente en intestino (mucho en el duodeno), riñón, hígado,
cerebro, paratiroides, páncreas (poco), suero sanguíneo, bilis, jugos
pancreático y duodenal. Su papel biológico no está claro, se ha indicado
una intervención en la síntesis o hidrólisis de la parathormona y
actuación opuesta a la succinato deshidrogenasa. Esta enzima, presente
también en pequeñas cantidades en orina e histoquímicamente localizada
en las “cerdas de cepillo” de los tubulus proximales, experimenta gran
aumento en los trastornos funcionales renales, pielografías
intravenosas, etc.3
Peptidil aminoácido hidrolasas
Atacan el terminal carboxílico COO. Se conocen con algún detalle trescarboxipeptidasas principales, dos de ellas segregadas principalmente
por el páncreas y la tercera, existente en la levadura.
- - Peptidil-L-aminoácido hidrolasa o carboxipeptidasa A
L-aminoácido. Es indispensable el grupo carboxilo libre y el enlace
péptido en el grupo amino del segundo aminoácido. Se segrega
abundantemente por el páncreas en forma de proenzima y al activarse por
la tripsina (o autocatalíticamente) pasa a enzima activa. Esta enzima se
utiliza como herramienta de trabajo en la secuenciación de aminoácidos.
- - Peptidil-lisina hidrolasa o carboxipeptidasa B
Peptidil-L-lisina + H2O → péptido + L-lisina Actúa sobre péptidos que
tienen un residuo C-terminal de L-arginina, por lo que se complementa
bien con la A para el estudio de las secuencias de aminoácidos.1
Dipéptido hidrolasas
Es un grupo interesante de enzimas segregadas por el jugo intestinal,aunque existe en otros órganos. Completan la hidrólisis proteica al
actuar sobre péptidos cortos no hidrolizados por otras enzimas
digestivas.
- - Glicil-glicina hidrolasa
- - Glicil-leucina hidrolasa
- - L-prolil-aminoácido hidrolasa o iminodipeptidasa
encuentra en la mucosa intestinal y riñón. Hidroliza también
L-hidroxi-prolilglicina.
- - Aminoacil-L-prolina hidrolasa o imidodipeptidasa
Peptidil péptido hidrolasas
- - Pepsina
Pepsina.
por las células de las glándulas fúndicas gástricas en forma de un
precursor denominado pepsinógeno, inactivo, que por la acción del ácido
clorhídrico estomacal o por la acción de la misma pepsina se trasforma
en la enzima activa, la pepsina, en una reacción autocatalítica.
Un 1% del pepsinógeno entra en la circulación sanguínea y luego se
elimina por vía renal como uropepsinógeno. Su determinación en orina se
utiliza en fisiopatología junto a otras pruebas, ya que se ha visto una
estrecha relación entre la secreción en reposo del estómago y la
excreción urinaria de uropepsinógeno.
Gracias al inhibidor de la pepsina y a la mucina, la mucosa gástrica
es capaz de protegerse de la autodigestión por parte de la pepsina. Es
de interés clínico el nivel de pepsinógeno en plama y suero en
diagnóstico de afecciones digestivas como ulcus ventricular, en
diagnóstico de carninoma gástrico, anemia perniciosa, cirrosis hepática.
También produce reacciones de transpeptidación. Los productos de la
hidrólisis péptica son, en general, mezclas de polipéptidos con pequeñas
cantidades de aminoácidos, que luego son hidrolizados por la tripsina y
otras enzimas. La pepsina se utiliza en laboratorio, por su efecto
proteolítico, para la caracterización de estructuras proteínicas y para
la purificación de sueros medicinales sin influir sobre los anticuerpos
(aumentando la tolerancia y reduciendo la posibilidad de rechazo).
- - Rennina
de origen renal. Parece hallarse en el estómago de los lactantes en
atención a que su pH es mayor que el del adulto y a que la pepsina
apenas resulta activa, por lo que la coagulación de la leche correría a
cargo de la rennina.
La rennina se utiliza en industria para fabricación de quesos.
- - Tripsina
celular hay cinco veces más tripsina que en el citoplasma, pero Golgi se
considera el sitio de producción de la enzima, ya que en sus gránulos
de zimógeno hay una elevada proporción de pre-enzimas proteolíticas. El
producto de las células pancreáticas en un pre-estadio, llamado
tripsinógeno, que en intestino es hidrolizado por la enterocinasa o
enteropeptidasa, aunque, el tripsinógeno puede ser activado también por
pequeñas cantidades de tripsina. Una vez activada la tripsina, se
encarga de la hidrólisis de enlaces peptídicos en que participan la
L-lisina o la L-arginina. Desdobla péptidos, amidas y ésteres de estos
aminoácidos. También se ha probado la presencia de tripsina en el
cristalino, leucocitos, eritrocitos, piel, parótida, riñón e hipófisis.
Gracias a su alta especificidad, resulta útil como herramienta de
trabajo para determinar secuencias de aminoácidos. En la coagulación
sanguínea es bien conocida su acción activadora, que coagula el plasma,
pues acelera la conversión de protrombina en trombina.
La resistencia del tejido vivo a la digestión por la tripsina está ligada a inhibidores naturales del organismo.
- - Quimiotripsina A y B
duodeno. Posteriormente es activada pasando a quimiotripsina. La
activación del quimiotripsinógeno la realiza la tripsina, o se puede
producir por autolisis.
La quimiotripsina rompe enlaces peptídicos del grupo carbonilo de un
aminoácido aromático (actividad de endopeptidasa). Puede actuar también
como carbonilproteinasa y como aminopeptidasa; además de proteínas y
péptidos puede romper enlaces ésteres y amidas de ácidos aromáticos.
La reacción se produce mediante la donación de protones de la serina y
un radical de histidina. Así el enlace a romper se une a la serina por
el grupo carbonilo y luego la parte NH2X es eliminada. Luego la enzima
se regenera hidrolizando el enlace que aún la une al residuo ácido, y
éste queda libre como segundo producto de la reacción.
- - Pancreopeptidasa E
neutros. Es eficaz en proteínas como la elastina, la fibrina, la
albúmina y la caseína, pero no en la queratina o el colágeno. Parece
estar relacionada con la arteriosclerosis, y es la única enzima
digestiva capaz de romper la elastina.
En el jugo duodenal se encuentra generalmente la elastasa activa,
mientras diversas proteínas presentes en el plasma le otorgan actividad
antielastasa.
- - Enteropeptidasa o enterocinasa
encargadas de la activación por hidrólisis, del tripsinógeno,
produciendo así la enzima activa y un hexapéptido.
- - Catepsina C y D
se encuentra en pequeñas concentraciones en diferentes tejidos animales
como bazo, riñón, hígado, leucocitos, eritrocitos y plaquetas, así como
en el estómago. La mayoría de catepsinas se localizan en los lisosomas.
Las catepsinas humanas se encuentran en tejidos como el cerebral, el
cristalino, la tiroides, la piel, etc. y parecen implicadas en los
procesos de necrosis y autólisis. La catepsina gástrica deriva de un
precursor común a la pepsina, la llamada “proteasa gástrica”. Pepsina y
catepsina realizan una función conjunta en la digestión
gastro-intestinal.4
- - Trombina y plasmina
trombina hidroliza péptidos, amidas y ésteres de la L-arginina, y
convierte el fibrinógeno
en fibrina. La plasmina (o fibrolisina) hidroliza los ésteres de la
L-arginina y la L-lisina, solubilizando la fibrina. Ambas participan
decisivamente en el proceso de coagulación de la sangre, que consiste
esencialmente en la conversión del fibrinógeno soluble en fibrina
insoluble. Un precursor de la trombina se encuentra soluble en el
plasma. Cuando varios factores lo convierten en trombina, ésta
transforma en fibrina el precursor fibrinógeno.El precursor de la
trombina se llama protrombina, e hidroliza cadenas proteicas.
Enfermedades como la hepatitis viral, la cirrosis hepática o la
metástasis ósea disminuyen la actividad de la antiplasmina, mientras
otras como la diabetes mellitus o el infarto cardíaco la aumentan
notablemente.
- - Renina
vasoconstricción; la hipertensina. Se encuentra en el tejido renal.
- - Queratinasa
Actuando sobre enlace C-N diferente al péptido
En amidas lineales
- - L-asparagina amidohidrolasa
una especificidad absoluta. Se encuentra en el intestino delgado e
hígado.
- - L-glutamina amidohidrolasa
- - Urea amidohidrolasa
bacterias, hongos, musgos, leguminosas, glóbulos rojos, hígado y bazo de
rata, así como en los eritrocitos humanos.
- - Penicilina amidohidrolasa
- - N-acilaminoácido amidohidrolasa
resolución de DL-aminoácidos: N-acilaminoácido + H2O → un ion de ácido
graso + un aminoácido Tiene amplia especificidad y también hidroliza
dehidropéptidos.
- - N-acilaspartato amidohidrolasa
- - α-acetil-L-ornitina amidohidrolasa
En amidas cíclicas
- - Barbiturato amidohidrolasa
- - L-4,5-dihidro-orotato amidohidrolasa y L-5-carboximetilhidantoína aminohidrolasa
En amidinas lineales
- - L-arginina hidrolasa
partir de hígado de mamíferos. En las hepatopatías aumenta el valor
sérico. También hidroliza L-argininas α-N-sustituidas y la canavanina.
- - Creatinina amidinohidrolasa
En amidinas cíclicas
- - Citosina, adenina, guanina, adenosina, citidina, AMP, ADP aminohidrolasas
inopina, uridina, IMP e IDP. Se encuentran en diversos tejidos de
animales mamíferos. La adenosina desaminasa se encuentra principalmente
en hígado, bazo, y bacterias. Aumenta en casos de ictericia
parenquimatosa, hepatitis aguda, cirrosis y malignoma.
En cianuros
- Nitrilo aminohidrolasa Cataliza la reacción: Nitrilo + H2O →carboxilato + NH3 Actúa sobre una amplia serie de nitrilos aromáticos,
incluyendo 3-indolacetonitrilo y también algunos nitrilos alifáticos.2
Actuación sobre enlaces de ácido–anhídrido
En anhídridos conteniendo fosforilo
- - Pirofosfato fosfohidrolasa
en todos los tejido en donde tiene lugar una calcificación. Destruye al
inhibidor de la precipitación del fosfato cálcico que se encuentra en el
plasma y la orina. Se ha hallado en la levadura, cerebro de rata,
eritrocitos, patata y músculos de insectos.
- - ATP fosfohidrolasa
tiene lugar en la miosina, actomiosina, mitocondrias, microsomas y
membrana celular. Algunas ATPasas también hidrolizan ITP y otros
nucleósidos 5-trifosfatos.
- - ATP difosfohidrolasa
- - Nucleósidodifosfato fosfohidrolasa
ortofosfato Actúa sobre IDP, GDP, UDP y el D-ribosa-5-pirofosfato.
- - ATP pirofosfohidrolasa
sobre ITP, GTP, CTP y UTP. Se encuentra en el semen y en el veneno de
serpientes.
- - Dinucleótido nucleótidohidrolasa
Actuando sobre enlaces C-C
En sustancias cetónicas
- - 4-fumarilacetoacetato fumarilhidrolasa
- - L-kinurenina hidrolasa
Actuando sobre enlaces haluro
En compuestos C-haluro
- - Alquil-haluro halurohidrolasa
En compuestos P-haluro
- - Di-isopropilfosforofluoruro flurohidrolasa
sobre otros compuestos organofosfóricos y “gases nerviosos”.
Actuando sobre enlaces P-N
- - Fosfoamida hidrolasa
Obtención de Esterasas
Muchas esterasas se obtienen del hígado de animales como el cerdo yel conejo. Las esterasas son utilizadas para la biocatalisis en la
práctica de síntesis orgánica durante los últimos 30 años, sobre todo en
síntesis de alcoholes en las que se obtengan mezclas racémicas. La
hidrólisis de esteres carboxílicos tienen un alto rango de sub-productos
por lo que la biocatálisis tienen una excelente selectividad
enantiomérica. Algunas esterasas son obtenidas por un pequeño número de
mutaciones alrededor del sitio activo de la enzima, de esta manera se
controla la selectividad de las enzimas.5
Hidrólisis catalizada por metaloenzimas
Hay esterasas dependientes de cinc en la hidrólisis de depsipéptidosen bacterias. El remover cinc de la termolisina termina con la actividad
enzimática como esterasa. La aplicación de Co y Zn con valencia 2+
restaura la actividad. Enzimas como la fosforilcolín esterasa (Pce),
descrita por primera vez en el año de 1974 en S. pneumoniae, dependen de
metales para funcionar, la presencia de esta enzima elimina un número
limitado de residuos de fosforilcolina de la pared celular. Pce es
inactiva frente a paredes celulares de bacterias crecidas en
etanolamina, aunque es capaz de hidrolizar otros sustratos de pequeño
tamaño como p-nitrofenilfosforilcolina o CDP-colina. La Pce es una
enzima dependiente de Cinc para su actividad. Se han hecho estudios en
los que se muestran que la apoenzima puede interactuar con otros iones
metálicos de carga 2+ como: Ca2+, Fe2+, Mg2+, Co2+, Cu2+ y Mn2+. 6
Estructura
Las enzimas dependientes de Cinc pueden tener una coordinación engeometría bipiramidal de base pentagonal o bipirámide trigonal
distorsionada,
El centro activo se localiza en la interfaz que generan las hojas-β,
donde hay una cavidad con un potencial electrostático altamente negativo
que alberga a los dos átomos de cinc.
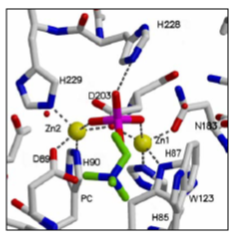
Centro binuclear de cinc con la molécula de PC
unida al centro activo. a. El modelo muestra el mapa de densidad
electrónica 2Fo – F contorneado a 1σ (naranja), y a 5σ (granate). Se
representan los átomos de cinc (bolas amarillas), los residuos
implicados en la coordinación de los metales y la molécula de
fosforilcolina (bastones).
unida al centro activo. a. El modelo muestra el mapa de densidad
electrónica 2Fo – F contorneado a 1σ (naranja), y a 5σ (granate). Se
representan los átomos de cinc (bolas amarillas), los residuos
implicados en la coordinación de los metales y la molécula de
fosforilcolina (bastones).
familia de las metalo-β- lactamasas, podemos ver que las esferas de
coordinación presentan esturcturas bipíramidales.
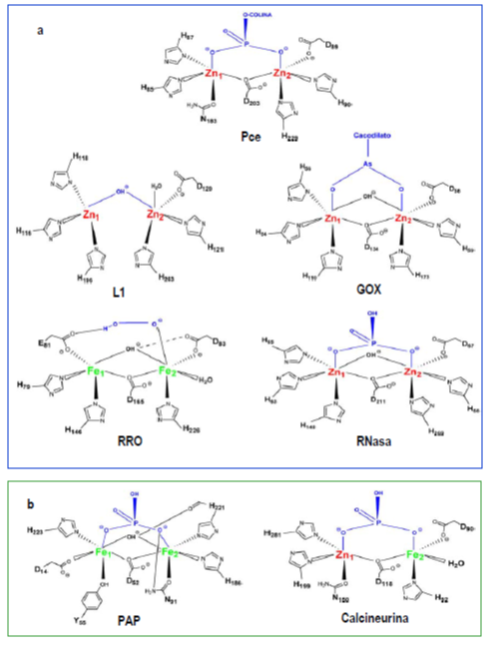
Comparación del centro metálico de Pce con los
de enzimas de la familia de las metalo-β- lactamasas (a) y de las
fosfatasas (b). Esquema de coordinación del centro binuclear de las
enzimas Pce; metalo-β-lactamasa de Xanthomonas Maltophilia, L1, (código
PDB 1SML); glioxalasa II humana, GOX, (código PDB 1QH5); rubredoxín
oxígeno: oxidoreductasa, ROO, (código PDB 1E5D); proteína de
procesamiento del ARN-t, RNasa Z, (código PDB 1Y44); fosfatasa ácida
púrpura, PAP, (código PDB 1UTE), y calcineurina (código PDB 1AUI).
de enzimas de la familia de las metalo-β- lactamasas (a) y de las
fosfatasas (b). Esquema de coordinación del centro binuclear de las
enzimas Pce; metalo-β-lactamasa de Xanthomonas Maltophilia, L1, (código
PDB 1SML); glioxalasa II humana, GOX, (código PDB 1QH5); rubredoxín
oxígeno: oxidoreductasa, ROO, (código PDB 1E5D); proteína de
procesamiento del ARN-t, RNasa Z, (código PDB 1Y44); fosfatasa ácida
púrpura, PAP, (código PDB 1UTE), y calcineurina (código PDB 1AUI).
Véase también
Referencias
- Laura Lagartera Ortiz, ESTRUCTURA Y FUNCIÓN DE LA FOSFORILCOLÍN ESTERASA DE Streptococcus pneumoniae, Madrid, 2006 ISBN 978-84-669-2969-1
Hasenpusch1, D. Möller1, U.T. Bornscheuer2, and W. Langel1,
Substrate-Enzyme Interaction in Pig Liver Esterase, Department of
Biophysical Chemistry, Institute of Biochemistry, University of
Greifswald




No hay comentarios:
Publicar un comentario